| |
И.В. Балычевцева, Л.А. Иванова, Гадецкая С.Г.
КЛИНИКО-ЛАБОРАТОРНЫЕ ОСОБЕННОСТИ ТЕЧЕНИЯ ЖЕЛЕЗОДЕФИЦИТНЫХ АНЕМИЯХ У ДЕТЕЙ ПЕРВОГО ГОДА ЖИЗНИ В ЗАВИСИМОСТИ ОТ ВИДА ВСКАРМЛИВАНИЯ
Донецкий государственный медицинский университет, Донецк, Украина
Введение: Среди всех анемий в детском возрасте наиболее часто встречается железодефицитная анемия (ЖДА). По данным ВОЗ, анемия, связанная с дефицитом железа, наблюдается у 56% детей раннего возраста [2]. Если учесть, что латентный дефицит железа (ЛДЖ) встречается в два раза чаще ЖДА, то распространенность сидеропении становится угрожающе высокой [1,3].
Проблема профилактики, диагностики и лечения ЖДА является чрезвычайно актуальной. Это обусловлено, прежде всего, морфофункциональными изменениями, которыми сопровождается гипосидероз. Одними из значимых являются дегенеративно-дистрофические процессы в желудочно-кишечном тракте, которые ведут к нарушению процессов пищеварения и абсорбции (синдром мальабсорбции), определяющих снижение местного иммунитета [1,4]. Другим важным аспектом сидеропении служат снижение интеллекта ребенка, обеднение его эмоциональной сферы (клинически это проявляется отставанием психомоторного развития детей). Дефицит железа сопровождается также снижением гуморального, клеточного иммунитета, фагоцитоза, что приводит к росту инфекционной заболеваемости [1,5].
Материалы и методы: Работа выполнена на базе Донецкого областного дома ребенка «Малютка».
Обследовано 89 детей, оставленных родителями на попечение государства в возрасте от 2 до 6 месяцев, из них у 45 были выявлены признаки анемии (50,6%), у 19 (21,3%) – был диагностирован латентный дефицит железа и у 25 детей (28,1%) клинических и лабораторных признаков железодефицитной анемии не установлено. Дети с установленной патологией были разделены на две группы, в первую группу вошли дети (23чел.), получавшие частично адаптированную смесь «Малыш». Вторую группу (22чел.) составили дети, находившиеся на искусственном вскармливании смесью «BONA». «BONA» - высокоадаптированная смесь с бифидобактериями, обогащенная железом, для кормления детей с момента рождения. Контрольную группу составили 18 здоровых детей (находящихся на грудном вскармливании).
Для исследования обмена железа у детей изучены: 1) параметры, характеризующие гемоглобиновый фонд железа (Hb – гемоглобин, Er – эритроциты, MCH – среднее содержание гемоглобина в эритроците, MCHC – средняя концентрация гемоглобина в эритроците), 2) концентрацию сывороточного железа (СЖ), латентную железосвязывающую способность сыворотки (ЛЖСС), процент насыщения трансферрина.
Первое обследование детей проводилось до назначения выше указанных смесей для вскармливания, второе – через четыре месяца их применения.
Результаты и их обсуждение:
При выяснении анамнеза наблюдаемых детей было установлено, что основными антенатальными причинами развития ЖДА были: недоношенность (7 случаев – 15,5%), глубокий и длительный дефицит железа в организме беременной (28 детей – 62,2%), внутриутробная инфицированность (14 детей – 31,1%д, из них цитомегаловирусом у 4 детей, вирусом простого герпеса – 2, хламидиями – 5). Среди интранатальных причин – ранняя перевязка пуповины (3 ребенка – 6,7%), многоплодная беременность (4 – 8,9%); среди постнатальных – недостаточное поступление железа с пищей (раннее искусственное вскармливание неадаптированными смесями в течение первых двух месяцев жизни, вскармливание коровьим молоком, несбалансированная диета у 8 детей – 17,8%), повышенные потребности в железе (недоношенность у 12 детей – 26,7%), нарушения кишечного всасывания – синдром мальабсорбции (2 ребенка – 4,4%).
Необходимо отметить, что обследованные дети были в основном из социально неблагополучных семей. У детей отмечен высокий показатель заболеваемости вирусными инфекциями. Обследуемые дети не имели грубой соматической и неврологической патологии. Группы детей были рандомизированы.
При более детальном изучении частоты встречаемости клинических проявлений эпителиального синдрома было установлено, что у 95% обследованных детей регистрировалась бледность кожных покровов и видимых слизистых, сухость кожных покровов и дистрофические нарушения со стороны волос и ногтей были отмечены у 86,6% детей (у 18 человек из первой группы и у 21 – из второй группы). Ангулярный стоматит и атрофия сосочков языка встречались у 20,0% детей с клиническими проявлениями анемии средней степени тяжести (у 6 человек из первой группы и у троих из второй группы).
При оценке тяжести течения железодефицитная анемия легкой степени была установлена у 36 детей (80%) – у 17 из первой группы и 19 из второй, средней тяжести у 9 пациентов (20%) – у 6 из первой группы и у 3 из второй.
Требуемое для ребенка количество питания рассчитывалось калорийным методом исходя из энергетической потребности ребенка соответствующего возрастной массы тела. Перевод детей на новый вид вскармливания осуществлялся постепенно с учетом индивидуальной переносимости. Период адаптации к вводимому питанию у всех обследованных детей протекал вполне удовлетворительно. Прикормы и коррекция вводились в положенные сроки и в полном объеме.
Проведенные исследования свидетельствовали, что при вскармливании детей, как смесью «Малыш», так и смесью «BONA» увеличение массы и длины тела детей соответствовали стандартным показателям для данной возрастной группы. Существенных отличий в динамике массо-ростовых показателей у детей, получавших предлагаемые смеси, не выявлено. Ряд клинических симптомов, присущих ЖДА – тахикардия, тахипноэ, адинамия, гипосомия и др. наблюдались в обеих группах до обследования, хотя эти проявления не являются специфичными для анемий, но на фоне применения высокоадаптированной смеси «BONA» отмечено улучшение в состоянии детей, что подтверждает правильность выбранной концепции вскармливания.
Оценивая показатели крови, представленные в таблице 1, следует отметить, что при первом обследовании в обеих группах детей они были практически одинаковыми и статистически не отличались друг от друга.
Таблица 1
Лабораторные показатели красной крови и обмена железа
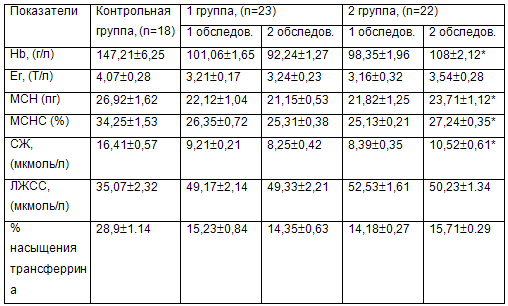
*- показатель статистически отличается от аналогичного первой группы.
При исследовании через 4 месяца (на фоне вскармливания различными смесями) было установлено, что у детей 1-й группы, получавших смесь «Малыш» имелась тенденция к снижению определяемых величин, а во 2-й группе некоторые из них имели тенденцию к нормализации.
У детей второй группы в основном констатировалась анемия легкой степени, а в первой группе увеличилось число детей с клиническими проявлениями анемии средней степени тяжести (при первом обследовании зарегистрирована у 6 детей при повторном – у 10).
При повторном исследовании было замечено, что среди детей, которые получали смесь «BONA», снизилась частота регистрации таких клинических симптомов как сухость кожных покровов, дистрофические изменения со стороны волос и ногтей, а ангулярный стоматит и атрофия сосочков языка более не встречались.
Таким образом, использование высокоадаптированной молочной смеси «BONA» у детей раннего возраста позволяет снизить частоту регистрации и степень тяжести железодефицитных анемий.
Список литературы:
1. Казакова Л.М. Профилактика дефицита железа в группе риска //Педиатрия.-2001.-№4.-С.98-100.
2. Коровина Н.А., Заплатников А.Л., Захарова И.Н. Железодефицитные анемии у детей.-Москва. -1999.-56с.
3. Майданник В.Г. Современные подходы к диагностике и лечению железодефицитных состояний у детей //Doktor.-2002.-№3.-С.86-88.
4. Соболева М.К. Железодефицитная анемия у детей раннего возраста и ее лечение актиферрином //Укр. медич. часопис.-1998.-№2(4).-С.129-133.
5. Соболева М.К., Косушкина Г.В., Надеев А.П. Особенности обмена железа у плода и новорожденного при внутриутробной инфекции //Педиатрия.-2001.-№3.-С.13-17.
Бессикало Т.Г., Недельская С.Н., Кузнецова Е.Д
КОНТРОЛЬ ЗА ТЕЧЕНИЕМ ПОЛЛИНОЗОВ У ДЕТЕЙ.
Запорожский государственный медицинский университет, г. Запорожье, Украина
Непосредственной причиной аллергических заболеваний является воздействие аллергенов. Заболевания, возникающие в результате сенсибилизации организма к пыльце ветроопыляемых растений, называют поллинозами. Они распространены широко во всем мире. По данным экспертов ВОЗ, ими страдают от 10% до 40% населения разных стран, а удельный вес поллинозов среди других аллергических заболеваний достигает 29% [1, 3].
Существует более 700 наименований аллергенов растений и их пыльцы. Естественно, для практической медицины имеют значение лишь наиболее причинно-значимые в возникновении аллергических заболеваний [3]. За последние годы в нашем регионе отмечается «эпидемиологический всплеск» поллинозов, пик которых приходится на август – сентябрь, в период палинации сорных трав (амброзии, лебеды, полыни и др., а в последние годы значительно возросла роль циклохены как причинного фактора). В сезон пыления этих растений количество вызов скорой помощи по причине обострения поллинозов в нашем городе в 2004 г. достигло 900, треть из них – вызова к детям.
К пыльце растений с наиболее выраженными аллергенными свойствами следует отнести пыльцу, содержащую сапонины, простые амины, простые алкалоиды, большое количество белка [3].
Весьма важной проблемой в настоящее время является изменение природных экзоаллергенов под влиянием факторов окружающей среды. Если раньше исследователи считали причиной поллиноза «географические различия и образ жизни», то в настоящее время основная роль отводится техногенным загрязнителям атмосферы. Уже доказано синергичное воздействие на организм человека пыльцы растений и пылевых частиц в атмосфере. Имеются данные о том, что загрязнители воздуха вызывают повреждение пыльцы, изменение её антигенных свойств, загрязненная пыльца индуцирует цитотоксические реакции, сенсибилизацию, повышает реактивность слизистой оболочки носа и бронхов [1]. Загрязнение пыльцы удлиняет сроки палинации аллергенных растений в зонах промышленных выбросов и изменяет антигенную структуру пыльцы, способствуя повышению ее аллергенности, воздействуя на генетический аппарат пыльцы [1]. В целом экологическая ситуация в Украине неблагоприятна на 40% территории [6].
Признаки болезни проявляются в период цветения причинно-значимых растений и исчезают после прекращения палинации их. Длительность ежегодных обострений поллинозов зависит от погодных условий и местной растительности [1,3].
Разнообразность клинических проявлений поллинозов обусловлена полиморфизмом симптомов заболевания, поэтому ранние признаки их часто не связывают с причинным фактором – пыльцой растений и диагноз аллергического заболевания ставится через много лет при уже сформировавшейся патологии [1,3].
Выделяют преимущественно респираторные формы поллинозов и кожные. У 50 – 90% больных обнаруживается риноконъюнктивальный синдром, который чаще всего дебютирует остро с рези в глазах, покраснения конъюнктивы, к которым присоединяются светобоязнь, зуд кожи век, кончика носа, неба, слезотечение, отек век, чихание, ринорея, которая сменяется периодами полной заложенности носа. Следующими в патологический процесс могут вовлекаться гортань, трахея и бронхи. Вовлечение последних ведет к развитию полленовой бронхиальной астмы. И при кожных, и при респираторных формах поллиноза у больных наблюдается синдром полленовой интоксикации. Вне периода цветения аллергенных растений симптоматика заболевания исчезает, и больные чувствуют себя практически здоровыми [1,3].
Самым эффективным методом лечения аллергии является элиминация причинно-значимого аллергена из окружающей больного среды. Но, к сожалению, это далеко не всегда осуществимо. Поэтому необходимы разработки методов профилактики и лечения этой группы заболеваний. На современном этапе фармакотерапия аллергических заболеваний (и поллинозов в том числе) направлена на: подавление аллергического воспаления (топические кромоны, топические и системные глюкокортикостероиды); подавление медиаторных механизмов (антигистаминные препараты и антилейкотриеновые); препятствие развития патофизиологических эффектов аллергии (симптоматическая терапия) [2].
Однако, основной упор в лечении поллинозов, на наш взгляд, должен быть направлен прежде всего на профилактику обострений. Поскольку шоковой клеткой аллергии является тучная клетка, в результате дегрануляции которой происходит выброс в кровеносное русло биологически активных веществ с развитием раннего и позднего аллергического воспаления, при невозможности проведения качественных элиминационных мероприятий терапия должна быть направлена на стабилизацию мембраны ее. Универсальными мембраностабилизаторами являются глюкокортикостероиды, которые эффективны в отношении как профилактики обострений аллергических заболеваний, так и в отношении лечения активного аллергического воспаления [4]. Однако в силу возможности развития целого ряда нежелательных побочных эффектов, согласно основным документам по диагностике и лечению респираторных форм аллергии, данная группа препаратов применяется при выраженных проявлениях аллергического заболевания.
В связи с появлением топических форм глюкокортикостероидов в настоящее время вопрос о применении препаратов кромоглициевой кислоты в схеме лечения респираторных форм аллергии стал дискуссионным, хотя эти препараты и включены в международные согласительные документы о лечении данной группы заболеваний. Поэтому эти препараты, ввиду их безопасности и эффективности у определенной категории больных, требуют дальнейшего изучения, отработки показаний к назначению, подбора оптимальных дозировок и определения времени назначения их [4].
В патогенезе поллинозов большая роль отводится гистамину, в связи с чем антигистаминные препараты широко показаны в комплексном лечении этих заболеваний [5].
В настоящее время все усилия медиков направлены на поиски путей профилактики аллергии и ее обострений. Учитывая значительный рост в последние годы тяжелых обострений поллинозов в нашем регионе, целью нашей работы было разработать способы профилактики и лечения их у детей с данным видом патологии.
Материалы и методы: под нашим клиническим наблюдением с августа – сентября 2004 года по настоящее время находятся 108 детей, больных поллинозом, в возрасте 6 – 15 лет, которые поступали в аллергологическое отделение в ургентном порядке или обращались за медицинской помощью амбулаторно по поводу обострения поллиноза. В нашей группе мальчики преобладали над девочками (65/43). У всех 100% детей имел место аллергический сезонный ринит, у 62 (57,4%) детей он сочетался с сезонным конъюнктивитом, у 36 (33,3%) – с бронхиальной астмой. У 1 ребенка имело место тяжелое течение поллиноза с тяжелой полленовой астмой, у 46 (43,6%) детей имело место среднетяжелое течение, у остальных – легкое течение.
Всем детям было предложено разработанное нами предсезонное профилактическое лечение в последующие сезоны, которое заключалось в применении за 2 недели до предполагаемого пыления причинно-значимых растений (вторая половина июля) и на весь период пыления (до средины октября) антигистаминных препаратов II поколения в возрастных дозах один раз в сутки и кромогексала местно (назальный спрей и, по показаниям, капли в глаза) в возрастных дозах 4 раза в сутки. Детям с тяжелым течением поллиноза и среднетяжелым течением поленовой астмы параллельно назначались ингаляционные глюкокортикостероиды в профилактических дозах.
Оценка эффективности терапии проводилась на основании традиционных критериев, в основе которых лежат наличие или отсутствие обострений, тяжесть их, потребность в симптоматической терапии и лечебных дозах глюкокортикостероидов.
Вне периода пыления больным была предложена специфическая аллерговакцинация причинно-значимыми аллергенами сорных трав.
Статистическая обработка полученных результатов проводилась с использованием пакета программ «Microsoft Excel», критерия Стьюдента. Достоверность различий считалась установленной при р<0,05.
Результаты и их обсуждение: Из 108 детей, которые находились под нашим наблюдением и получили соответственные рекомендации, родители только 52 (47,2%) пациентов выполняли их (I группа), 22 (20,3%) – выполняют их нерегулярно (II группа), 5 (4,5%) пациентов регулярно покидают наш климато-географический район на весь период пыления сорных трав, поэтому мы их исключаем из оценки в данной работе. Остальные 25 (23,1%) пациентов рекомендации не выполняют (III группа).
Проведя катамнестическое исследование мы выявили, что у детей, которые получают предсезонную профилактику по предложенной схеме (I группа) в 100% случаев имела место значительная положительная динамика в течение поллиноза (рис. 1). Не было ни одного случая тяжелого или среднетяжелого сезонного обострения заболевания. У 15 (28,8%) пациентов имели место легкие эквиваленты обострения (легкие заложенность носа и/или зуд глаз и/или кашель) в период максимальной палинации, которые купировались кратковременным применение симптоматических препаратов (в течение 1 – 2 суток).
Во II группе больных состояние без динамики отмечалось у 18 (80,8%) больных, а в III группе – у 100% детей, что послужило причиной применения длительно симптоматической терапии и лечебных доз топических стероидов (рис. 1).
В нашем случае ни у одного больного, получающего профилактическую терапию, не отмечалось никаких описанных выше побочных действий этих препаратов.
Исходя из всего выше изложенного, можно сделать следующие выводы:
1. Предсезонное назначение препаратов кромоглициевой кислоты местно и антигистаминных препаратов II поколения в сочетании с профилактическими дозами топических стероидов (по тяжести заболевания) является высокоэффективным способом профилактики обострений поллинозов.
2. Применение предсезонной профилактики обострений поллинозов этими препаратами, помимо клинической эффективности, значительно снижает потребность в симптоматических препаратах и топических глюкокортикостероидах.
3. Применение предсезонной профилактики препятствует трансформации поллинозов в более тяжелое течение.
4. Предсезонная профилактика поллинозов способствует значительному повышению качества жизни больных.
Список литературы
1. Алешина Р.М. Пыльцевая аллергены: клинико-аллергологическая диагностика и специфическая иммунотерапия. // Клінічна імунологія, алергологія, інфектологія.-2006.- №2(03).- С.4-9.
2. Зайков С.В. Диагностика и лечение аллергических заболеваний – актуальная задача медицины // Актуальная тема. – 2005. - №11-12 (171-172). – С.10.
3. Пухлик Б.М. Элементарная аллергология / Винница, 2002. – 147 с.
4. Пухлик Б.М., Корицкая И.В. Комбинированная терапия аллергических заболеваний органов дыхания // Астма та алергiя. – 2005. - №1. – С.5-8.
5. Рациональная фармакотерапия заболеваний органов дыхания / под общ. ред. А.Г.Чучалина. – М., «Литтера», 2004. – Т.V. – 873 С.
6. Савицкий В.Д., Савицкая Е.В. Экология и распространенность пыльцы аллергенных растений в Украине // Астма та алергiя. – 2002. - №2. – С.17-20.
Рисунок 1.
Оценка эффективности предсезонной профилактики поллиноза
Примечание:
1 – состояние без динамики на фоне проводимой терапии;
2 – эквиваленты обострений (легкие проявления ринита, конъюнктивита, кашель);
3 – кратковременная потребность в симптоматических препаратах (деконгестанты, бронхолитики короткого дйствия);
4 – потребность в лечебных дозах топических глюкокортикостероидов.
ХАРАКТЕРИСТИКА ФІЗИЧНОГО РОЗВИТКУ ЮНАКІВ
О.Є. Бабунова
Дніпропетровська дитяча міська клінічна лікарня №6
м. Дніпропетровськ
На сучасному етапі основою первинної профілактики в педіатрії є визначення схильності дітей до захворювань та їх своєчасна профілактика з метою зміцнення та збереження здоров?я дитячого населення України. Особливої уваги потребує визначення рівня стану здоров?я юнаків допризивного віку.
Метою проведеного дослідження було визначення особливостей фізичного розвитку як основного показника стану здоров?я у 417 юнаків віком 15-16 років, за загальноприйнятими антропометричними показниками з використанням центильних таблиць. На момент обстеження діти не пред?являли скарг та були соматично здорові.
За результатами досліджень було виявлено, що середній фізичний розвиток реєструвався у 64,3% юнаків. Фізичний розвиток нижче середнього зустрічався у 12,9% дітей. У 22,8% юнаків відмічався фізичний розвиток вище середнього.
Проведена оцінка гармонійності фізичного розвитку виявила, що дисгармонійний фізичний розвиток реєструвався у 34,8% дітей. Гармонійний фізичний розвиток відмічався у 65,2% обстежених, переважно з середніми показниками росту, маси тіла та кола грудної клітини.
Нормальні показники росту реєструвалися у 65,2% юнаків, ретардація росту - у 13,6% дітей, а акселерація – у 22,1% обстежених.
Особливості фізичного розвитку юнаків, що характеризують їх адаптаційні можливості, необхідно враховувати при оцінці загального стану здоров?я цієї категорії дітей та розробки індивідуальної програми профілактики та реабілітації, спрямованої на ціленаправлене підвищення їх адаптаційних резервів.
|